Теория остеопластики: блоки, стружка, биоматериалы и остеогенез.
Уважаемые друзья, прежде, чем мы начнем обсуждать сегодняшнюю тему, я вновь хочу обратить ваше внимание на статью: «Факторы успеха остеопластических операций». Она объясняет, от чего зависит результат остеопластических операций, почему в одних случаях у нас нет проблем с наращиванием костной ткани, а в других — возникают осложнения и ничего не получается. Тогда я выделил пять факторов, учёт которых при планировании и проведении хирургических вмешательств, делает остеопластические операции более предсказуемыми, безопасными и гораздо менее рискованными.
Фактор I. Жизнеспособность графта и/или принимающего ложа
Фактор II. Отсутствие инфекции до, во время и после операции
Фактор III. Герметичность послеоперационной раны
Фактор V. Отсутствие внешних воздействий
А сегодня я хотел бы поговорить с вами о том, что общего между различными методиками остеопластических операций, как они работают, почему нельзя противопоставлять различные варианты наращивания костной ткани и говорить, что «один метод лучше, а другой хуже». Другими словами, речь пойдет не столько о методологии и технологии, сколько о теории остеопластики — что нужно знать, чтобы любая операция заканчивалась гарантировано хорошим результатом.
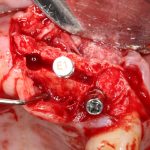
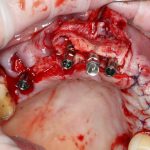
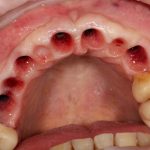
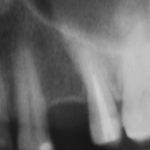
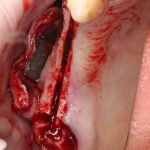
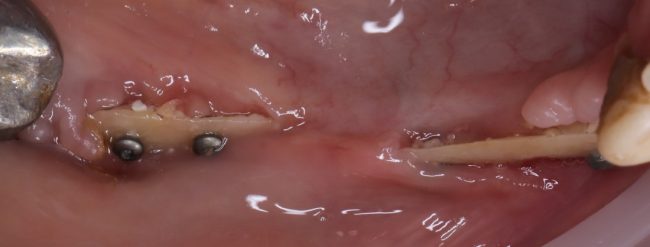
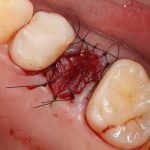
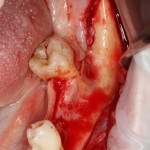
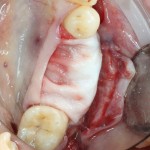
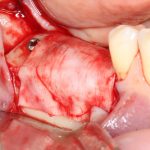
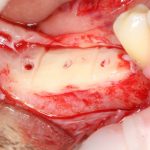
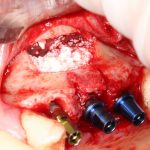
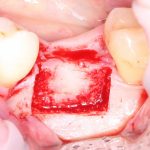
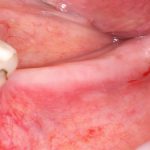
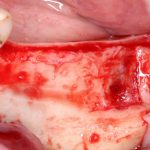
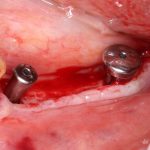
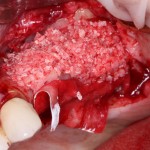
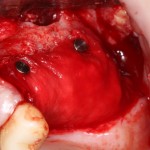
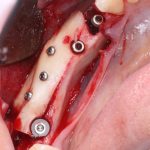
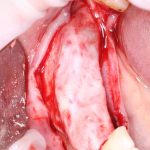
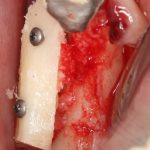
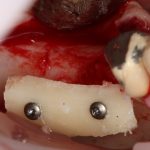
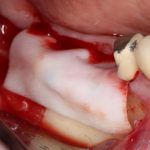
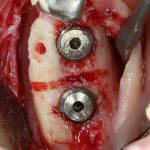
Я постараюсь показать вам, почему из этого:
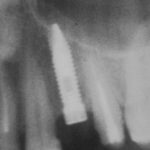
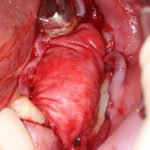
получается это:
с минимальными затратами сил, нервов и денег. Этого не объяснить в рамках видеофильма или показа отдельного клинического случая. Это невозможно прочувствовать на челюсти барана или корке апельсина. В конце концов, если кто-то из докторов пожелает увидеть это «вживую», так сказать, с эффектом полного присутствия — очень скоро мы возобновим Индивидуальный Практический Курс и… добро пожаловать!
Внятная терминология и классификация
Как недавно сказал мой уважаемый коллега Фирас Кики, вся возникшая в современной медицине путаница — следствие отсутствия внятной и общепринятой терминологии. Имплантология — не исключение. Обилие разных имплантологических школ, разных авторов и просто огромного числа мудаков «сект по интересам», нередко приводит к тому, что одно и то же понятие имеет несколько значений,зачастую противоположных. Дабы избежать дальнейшей путаницы, я предлагаю начать с обозначения четкой терминологии и классификации.
Итак, что такое остеопластика? Как ни странно, это понятие не всегда равнозначно народному «наращиванию костной ткани». В более глобальном смысле:
Остеопластика — это изменение конфигурации альвеолярного гребня челюсти с целью подготовки его к установке дентальных имплантатов и/или протезированию.
То есть, остеопластика вовсе необязательно сопровождается «наращиванием» костной ткани, иногда это может быть простое изменение формы гребня как, например, при расщеплении альвеолярного гребня:
или т. н. «закрытый» синуслифтинг:
которые, строго говоря, «наращиванием» не являются.
И, несмотря на обилие видов остеопластических операций, — а сейчас каждый более-менее известный доктор имеет свой «авторский» метод, — их все можно свести к простой и понятной классификации. Она представлена на схеме ниже:

Может быть, эта схема не очень понятна с первого взгляда, но зато под действием алкоголя отражает взаимосвязи различных методик и поясняет, как в комбинации простых методов появляются новые виды остеопластических вмешательств. Например, если вы обратили внимание, «закрытый» и «открытый» виды синуслифтинга относятся к разным типам остеопластических операций, горизонтальной остеотомии и направленной костной регенерации (НКР), соответственно, а большинство комбинированных видов костной аугментации сочетают в себе именно аутотрансплантацию крупных костных фрагментов (АККФ) и НКР.
В общих чертах, все существующие виды остеопластических операций можно разделить на два больших типа:
- не связанную с перемещением тканей модификацию
- и перемещение тканей с одного участка в другой, либо помещение в организм биоматериалов — трансплантацию.
Последняя, в свою очередь, делится на три большие группы:
- аутотрансплантация крупных костных фрагментов (АККФ)
- направленная костная регенерация (НКР)
- комбинированные методики (имеющие, как правило, жаргонное или авторское название), включающие в себя элементы двух первых групп.
Например, расщепление альвеолярного гребня — это классический пример вертикальной остеотомии:
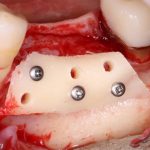
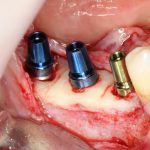
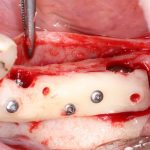
известная всем пластика костным блоком — не что иное, как аутотрансплантация крупного костного фрагмента:
мембранная аугментация — один из вариантов каркасной методики НКР с резорбируемым каркасом:
а использование титановой сетки — та же НКР, но уже каркасная нерезорбируемая:
И, наконец, «ламинарная техника»:
и прочие «сендвичи»:
являются примерами комбинированных методик, сочетающих в себе как пересадку крупного костного фрагмента, так и использование резорбируемой каркасной НКР.
Давайте запомним эту классификацию, поскольку мы периодически будем к ней возвращаться.
Как «работают» остеопластические операции, и что происходит после того, как мы наложили последний шов?
Ежу понятно, что то, что мы наделали в ходе остеопластической операции, еще не является костной тканью челюсти в полном смысле этого слова. Мы просто создали условия для регенерации костной ткани. И всё. Теперь, нам остается лишь надеяться, что костная ткань, как и все ткани в области послеоперационной раны, регенерирует.
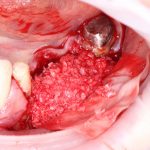
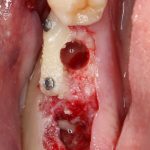
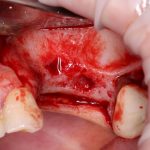
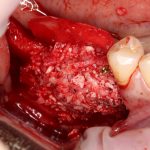
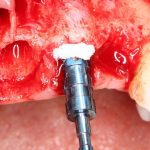
Но прежде, чем это произойдет, в созданной нами послеоперационной ране должны пройти и завершиться определенные процессы, хорошо описанные в соответствующих университетских учебниках. Увы, но без знания этих процессов, невозможно понять, как проходит образование новой костной ткани, и почему в одном случае остеопластика обречена на успех, а во втором получается полная лажа, типа такой:
Допустим, мы провели остеопластическую операцию, причем совершенно не важно, каким методом, наложили швы, сделали назначения и отпустили пациента домой. Что дальше происходит в послеоперационной ране?
Любую операцию организм воспринимает как травму, нарушение собственной целостности, и отвечает на нее соответствующей реакцией. Называется эта реакция воспалением, она является типичной, хотя и сильно разнообразной по симптоматике, для всех видов сильного воздействия на организм. За любым, абсолютно любым хирургическим вмешательством следует воспалительный процесс. Смиритесь с этим. Это нормально. Важно лишь, чтобы в послеоперационном периоде он не выходил за определенные рамки и оставался под контролем.
Если мы представим сильно упрощенную динамику послеоперационного воспалительного процесса в виде графика, где по оси абсцисс у нас будет время, а по оси ординат — степень проявления, то получим следующее:
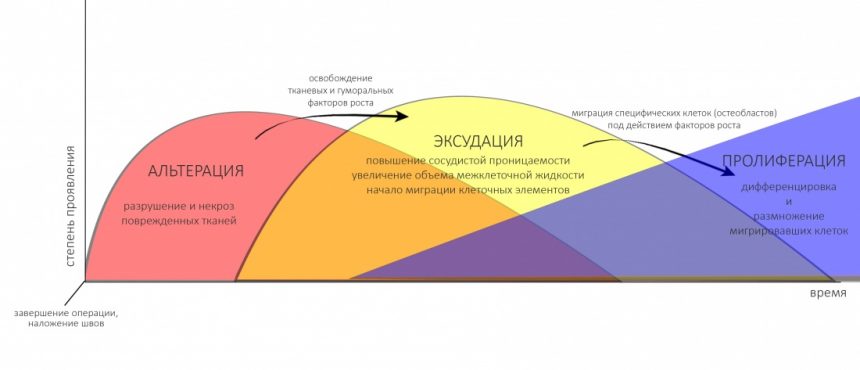
Еще раз повторюсь — динамика на графике представлена очень-очень приблизительно, без учёта фактора инфицирования, влияния ферментов полости рта и общего состояния организма. Однако, она наглядно объясняет симптоматику (появление болей, отеков, кровотечений и т. д.) послеоперационного периода и то, почему после хирургического вмешательства нужно принимать определенные лекарства и соблюдать рекомендации врача.
Пролиферация, последняя фаза послеоперационного воспалительного процесса, характеризуется усилением деления клеток и, как следствие, регенерацией поврежденных тканей. Если мы говорим именно о костной ткани челюстей, то на клеточном уровне это происходит следующим образом:
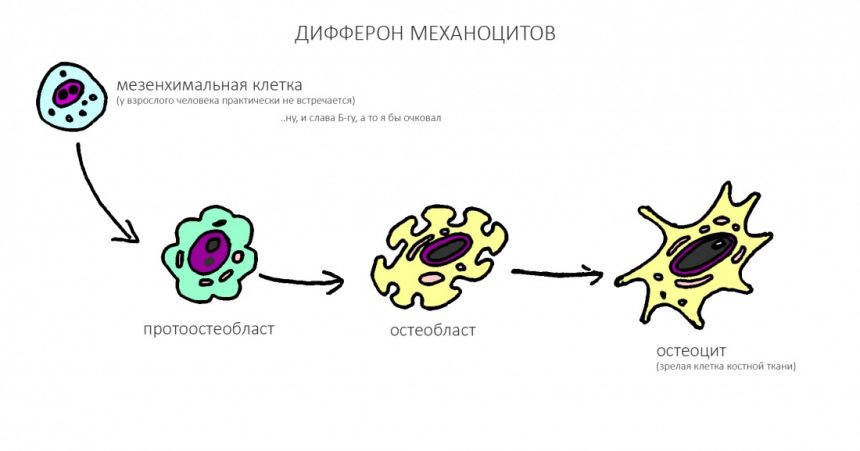
Как вы успели заметить, мезенхимальных клеток, к счастью, у нормального половозрелого человека, к счастью, почти нет. Почему к счастью? Потому, что эти малодифференцированные клетки весьма нестабильны и могут превратиться в любую хрень. В злокачественную опухоль, например.
Ну и, Капитан Очевидность подсказывает нам, что клетки костной ткани, остеоциты и остеобласты, проще и быстрее получаются только из клеток костной ткани — остеобластов. Этот базовый принцип клеточной теории еще в девятнадцатом веке сформулировал немецкий учёный Рудольф Вирхов:

Omni cellula a cellula! (лат. — «Клетка от клетки!»)
а сейчас вам об этом расскажет любой студент медицинского вуза, не забывший гистологию и биологию.
И теперь, зная всю эту фигню про Вирхова, клеточную теорию и остеогенез, можно сформулировать два главных тезиса регенерации при остеопластических операциях:
Тезис #1.
Костная ткань не берется из ниоткуда, её источником служит только костная ткань. А это значит, что никакие биоматериалы, замачивай ты их в крови, PRF, соплях или керосине, в костную ткань не превращаются. Впрочем, я неоднократно об этом писал.
Тезис #2.
Миграция клеток, рост, формирование и минерализация костной ткани идут только со стороны костной ткани, но никак не со стороны надкостницы. Более того, никаких «островков остеогенеза» внутри чистого графта, пропитанного кровью, PRF, соплями или керосином, не образуется.
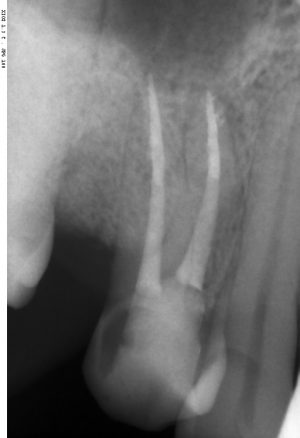
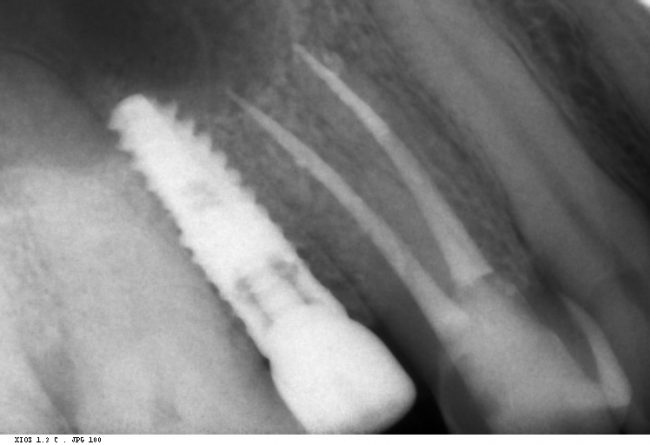
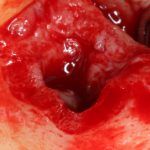
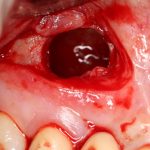
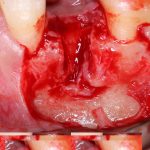
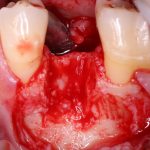
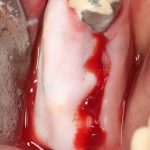
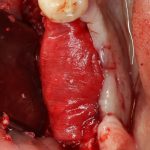
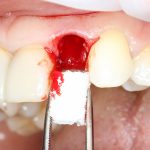
Вот. к примеру. лунка зуба через месяц после удаления. Внимательно посмотрите на её края:
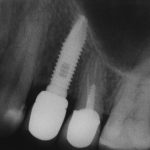
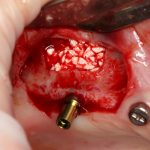
По периметру лунки вы видите новообразованную, очень слабо минерализованную, но уже костную ткань, называемую остеоидом. По консистенции остеоид больше похож на хрящ, в нем мало кальция и на снимках его не видно, но… в нем много клеточных элементов, активно идут репаративные процессы. Это самое время для имплантации:
Какое значение всё это имеет для остеопластических операций?
Как ни странно, первоочередное. Самое главное. Потому, как зная и понимая процессы, происходящие с костью в процессе регенерации, мы начинаем осознавать, от чего зависит успех/неудача той или иной остеопластики. И, может быть, не владея вообще никакими общеизвестными методиками наращивания костной ткани, мы можем с хорошим результатом провести остеопластику каким-то своим особым методом — и не сомневаться в удовлетворительном результате.
Строение и биотипы костной ткани
С точки зрения гистологии (очень упрощенно), костная ткань состоит из двух компонентов: клетки костной ткани (остеобласты, остеоциты, остеокласты) и межклеточное вещество. То, что мы с вами называем, собственно, «костью», на самом деле, является межклеточным веществом, содержащим неорганический компонент: кристаллы гидроксиапатита и обеспечивающим твердость, механическую прочность и другие физические свойства костной ткани. Более того, именно межклеточное вещество, а точнее — градиент ионов кальция, мы видим на рентгеновских снимках и, разумеется, воспринимаем их как «кость»:
Ежу, как и человеку, не спавшему на лекциях по гистологии и биологии, хорошо понятно, что межклеточное вещество не принимает участия в регенерации кости, и что, в соответствии с клеточной теорией и нашим тезисом #1, источником новой костной ткани служат только клетки костной ткани. И, следовательно, чем больше удельное количество клеток мы имеем в кубическом сантиметре костной ткани, тем лучше будут идти в ней репаративные процессы. Логичный вывод? Логичнее не бывает.
Удивительно, но в отличие от ежей, этого не могут понять некоторые доктора, среди которых встречаются очень авторитетные специалисты. Именно они периодически продуцируют бред про «плохую» (рыхлую) и «хорошую» (плотную) костную ткань, какие-то запредельные усилия (100 Нм — «хорошо», а 10 Нм — «плохо») при установке имплантов.
Не существует «хорошей» или «плохой» костной ткани. Любая костная ткань — нормальная, с любой костной тканью можно работать.
Запомните это. Или запишите куда-нибудь, если запомнить не удается.
Ну, да ладно, вернемся к нашим баранам, к строению костной ткани.
Челюстная кость, как, впрочем, любая другая, неоднородна по своей структуре. В её наружном слое, называемом кортикальной (или компактной) пластинкой, преобладает межклеточное вещество с высокой степенью минерализации. Во внутренней части, губчатом веществе, наоборот, межклеточного вещества не так уж и много, зато присутствует большое количество клеточных элементов, сосудов и нервов.
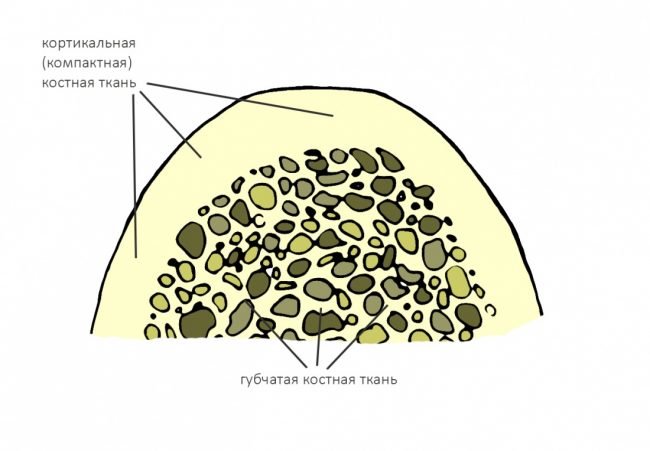
Соотношение внешней кортикальной и внутренней губчатой части челюстной кости определяет ее биотип.
В этой статье я уже рассказывал про биотипы костной ткани и том, почему это важно при планировании имплантации. Вот картинка, поясняющая, что такое биотипы, и в чём между ними разница:
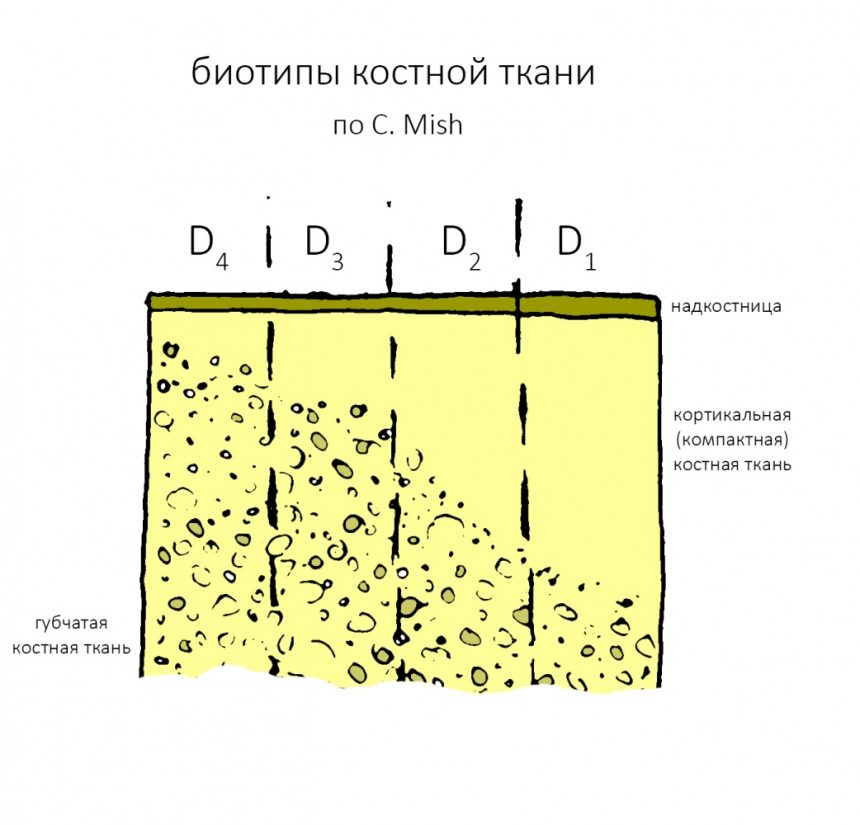
Зная биотипы, удельное содержание клеточных элементов костной ткани, роль межклеточного вещества и то, как всё это влияет на регенераторные процессы, мы можем сделать интересные выводы:
- Биотипы D1 и D2 — наиболее сложные для имплантации и остеопластики, поскольку имеют выраженную кортикальную пластинку, почти не имеющую клеточных элементов, необходимых для регенерации. Это противоречит общепринятым представлениям, но именно так оно и есть. Смиритесь и отправляйтесь учить гистологию.
- Аутотрансплантация кортикальный блоков к кортикальной же костной ткани не приводит ни к чему хорошему. Отсутствие кровоснабжения у такого регенерата объясняет их резорбцию и утрату в долгосрочной перспективе. Чтобы этого не происходило, есть несколько секретов, о которых речь пойдет позже.
- То же самое касается метода направленной костной регенерации без подготовки принимающего ложа, пусть и в меньшей степени. Миграция клеток из компактной пластинки кости затруднена по причине их почти полного отсутствия. Это объясняет неудачи применения чистых биоматериалов при НКР и то, почему регенерация нуждается в дополнительных стимуляторах в виде аутокостной стружки — при её разрушении остеокластами и прочими макрофагами, образуются факторы роста, влияющие на миграцию и формирование остеобластов.
Теперь, уважаемые друзья, вы самостоятельно можете понять и объяснить, почему некоторые методики остеопластики «работают» хорошо, а другие — не очень. И почему вместо посещения всяких семинаров и учебных курсов, сводящихся, в основном, к подражательству («делай, как я!»), стоит, как минимум, повторить университетскую программу по гистологии, биологии и патологической анатомии и, как максимум, изучить общехирургическую и травматологическую литературу в вопросах, касающихся остеогенеза.
Понятие периметра
Теперь попробуем применить вновь полученные знания к остеопластическим операциям.
Из тезиса #2 следуют три важных вывода.
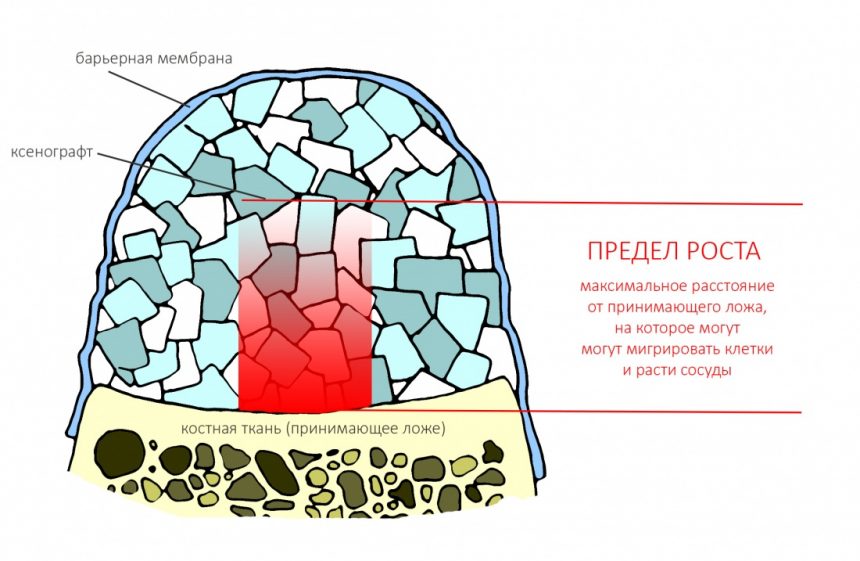
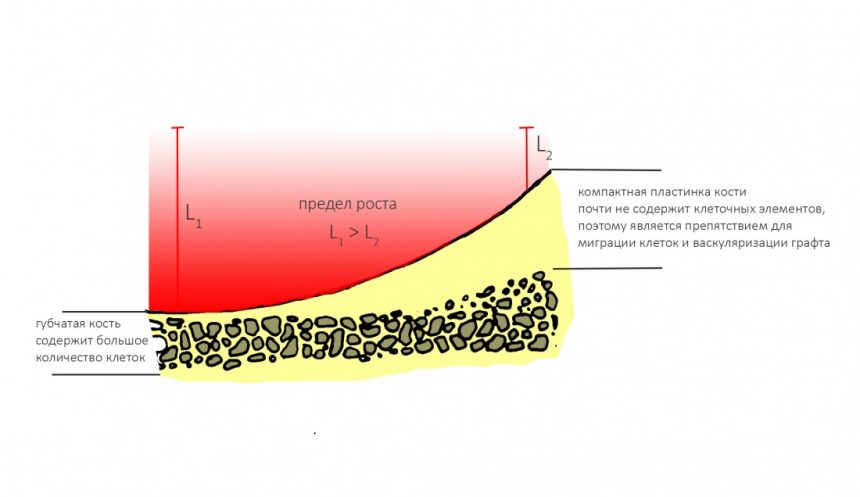
Вывод #1. У остеопластической операции с использованием чистых биоматериалов есть предел. Я называю его пределом роста. Он определяется скоростью и расстоянием миграции остеобластов и других клеток, участвующих в остеогенезе, ростом микрососудистого русла и т. д.:
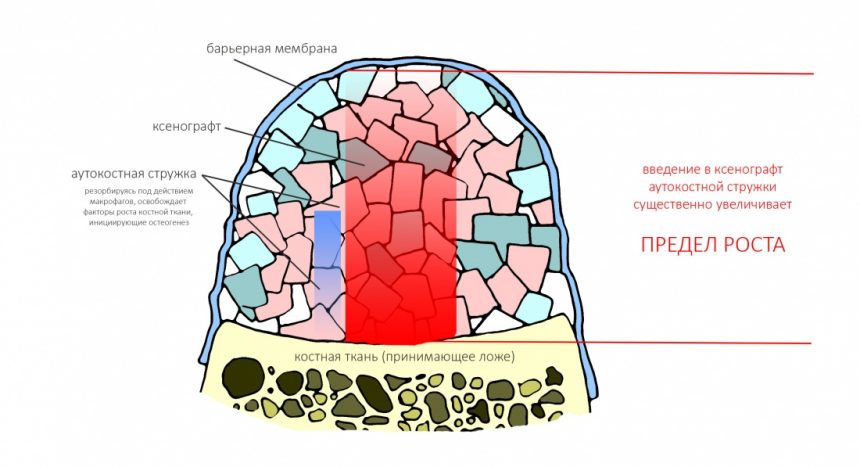
Создание смешанного графта (т. е. введение в биоматериал аутокостной стружки) серьезно расширяет предел роста, но не преодолевает его. Причём, лишь небольшая (около 30%) аутокостной стружки участвует в регенерации, остальное «съедается» остеокластами и прочими макрофагами, при этом освобождаются т. н. «факторы роста» костной ткани — гормоноподобные вещества, инициирующие механизм остеогенеза:
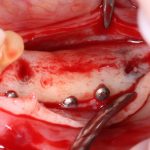
Вывод #2. Чем больше площадь соприкосновения графта с костной тканью, тем больше миграции клеток, тем лучше он прорастает сосудами (васкуляризируется):
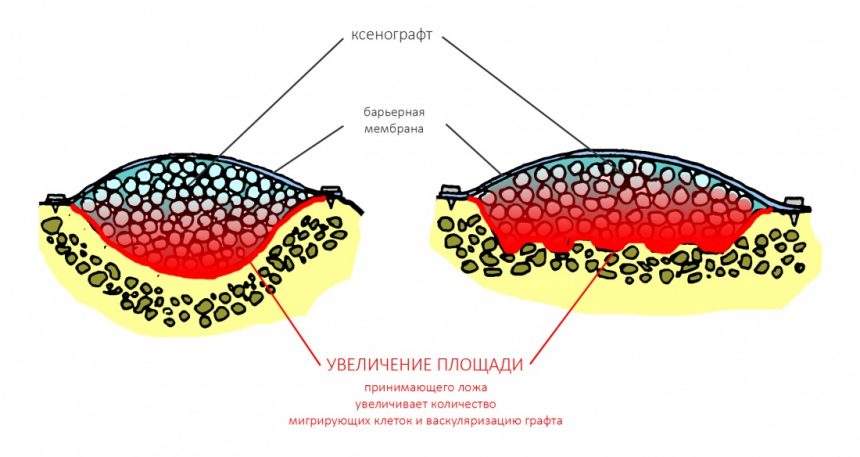
Следовательно, искусственно увеличив площадь контакта принимающего ложа с графтом, мы существенно повысим вероятность успешного результата остеопластической операции.
Вывод #3. Чем выше удельное содержание клеток в принимающем ложе — тем лучше идёт их миграция и формирование регенерата. Хотя бы потому, что клеток, способных к миграции и дифференцировке больше:
И теперь, чтобы переложить эти теоретические выводы на практическую плоскость, нам необходимо ввести еще одно понятие, пусть не совсем верное с точки зрения геометрии, но более объяснимое — это понятие периметра.
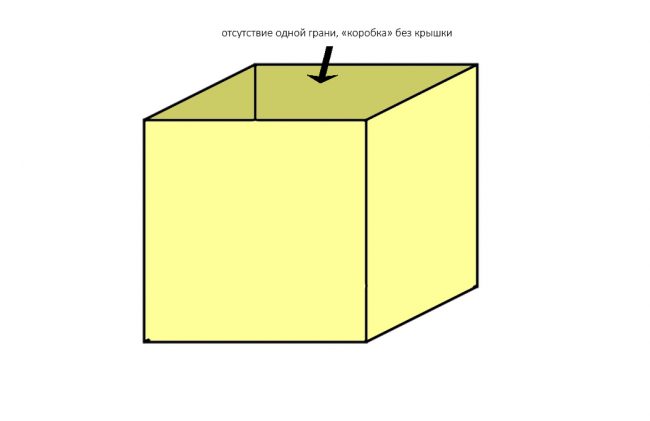
Любые костные дефекты челюстей мы можем представить в виде шестигранника (гексаэдра) или, если хотите, в виде куба:
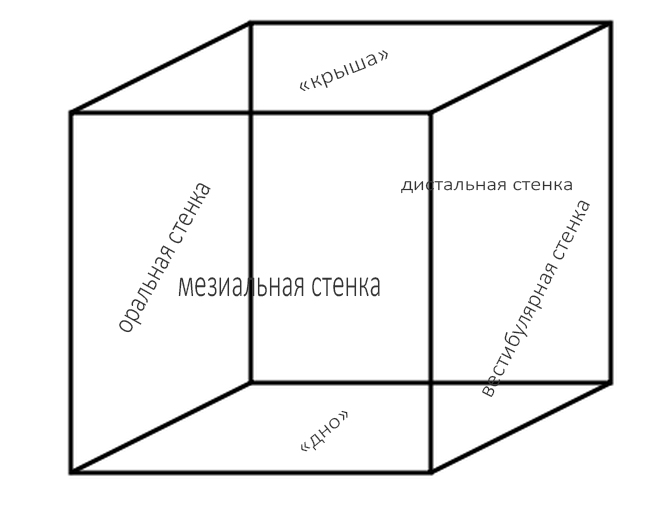
По отсутствию одной или нескольких граней мы можем легко их классифицировать.
Например, отсутствие одной костной стенки характерно для полостей после цистэктомии:
или лунок зубов:
и т. д.
Отсутствие двух стенок — «классика жанра»:
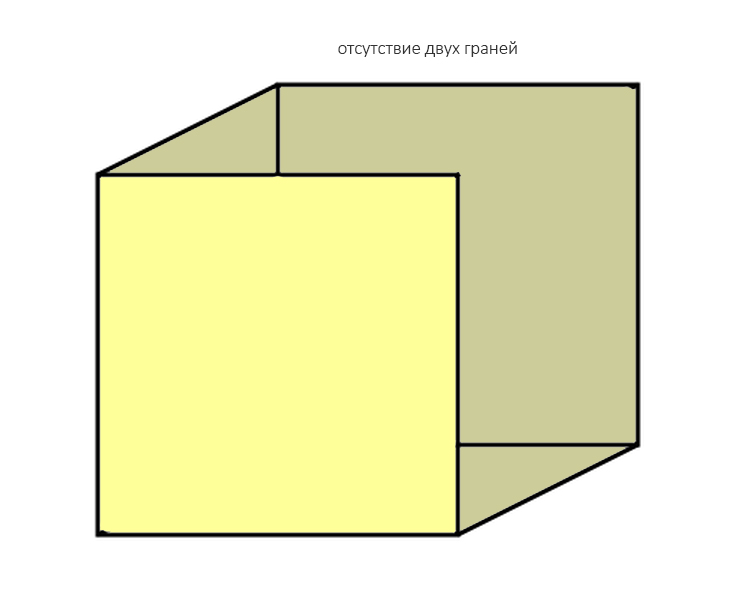
к ней относятся большинство видов атрофии при длительном отсутствии зубов:
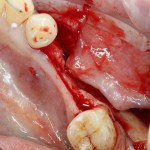
Ну и, отсутствие трех стенок характерно для значительных дефектов кости:
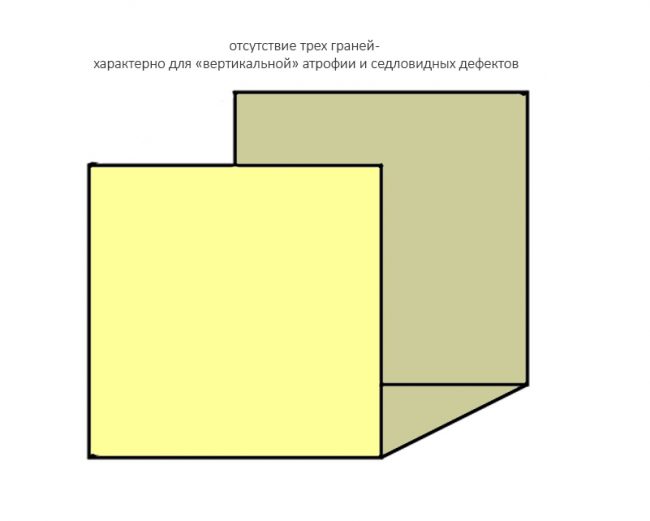
например, для седловидных или т. н. «вертикальных» дефектов:
И крайняя степень — отсутствие четырёх или пяти стенок:
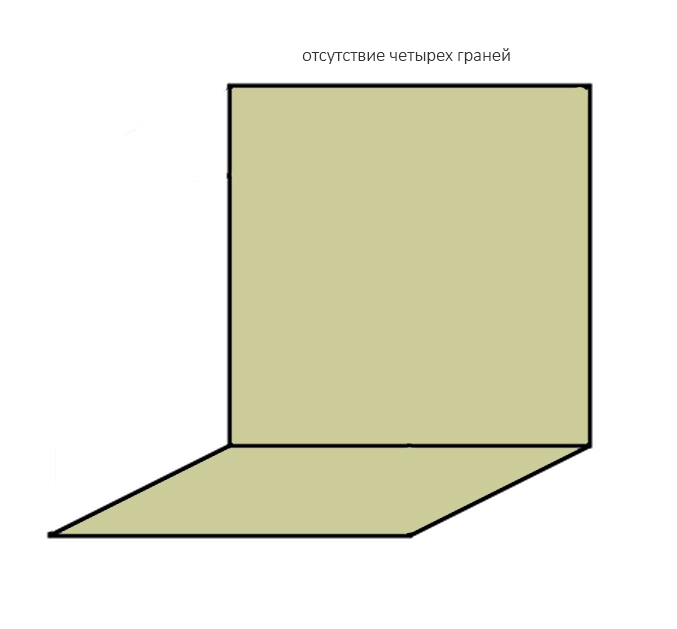
ставит под сомнение целесообразность проведения остеопластики, поскольку добиться качественного результата в таких случаях крайне сложно:
но вполне возможно:
Сопоставив понятие периметра с тем, что мы теперь знаем об остеогенезе, легко объяснить, почему при проведении синуслифтинга, в принципе, можно использовать биоматериалы без добавления аутокостной стружки:
Мы имеем дефект с сохранением пяти стенок из шести, с большой площадью поверхности и относительно небольшим расстоянием до центра:
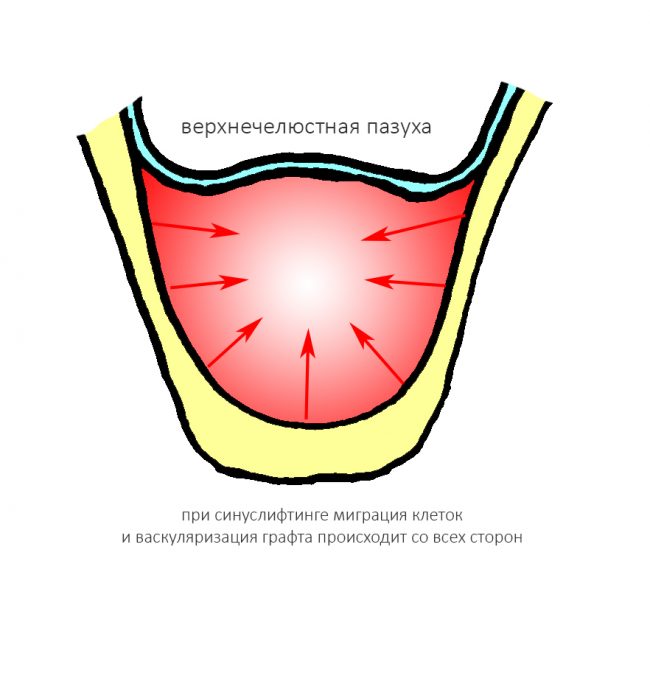
где миграция клеток и васкуляризация идет от периметра к центру со всех сторон и предел роста как таковой, в принципе отсутствует.
И наоборот, такой же по объему дефект, но не имеющий двух или трех стенок, «чистым» биоматериалом, практически, не вытянуть, поэтому мы должны (нет, обязаны!) добавлять в ксенографт аутокостную стружку:
что, как я уже писал, увеличивает предел роста:
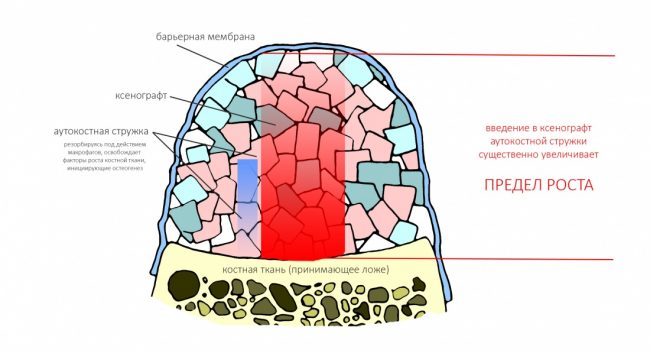
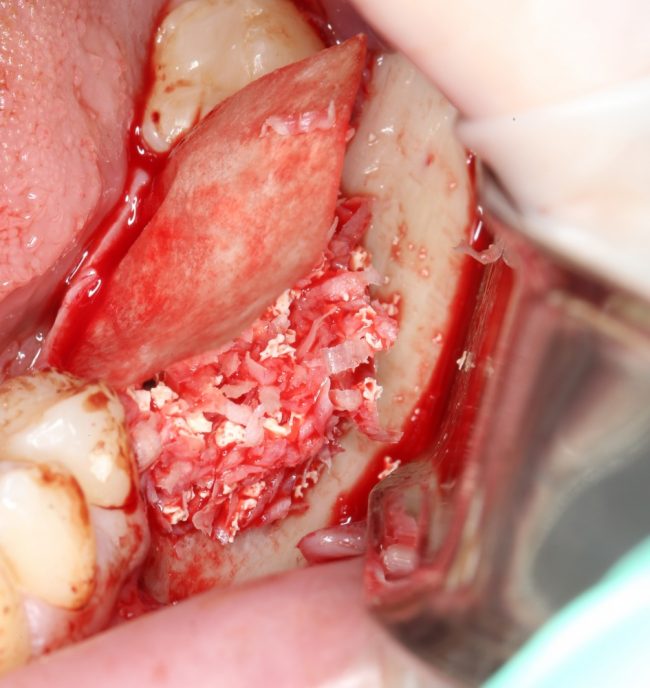
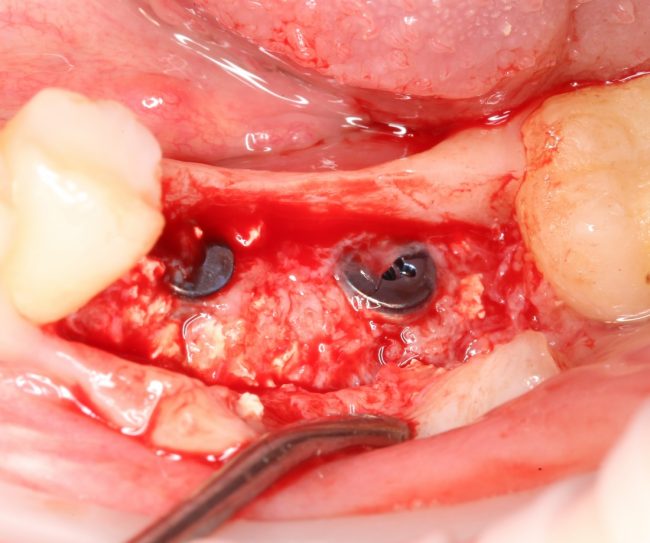
И дает возможность получить нормальный результат остеопластики почти в любом объеме.
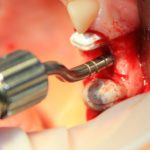
Кстати, иногда меня спрашивают, как я отношусь к предлагаемым некоторыми компаниями ксенографтам в виде блоков, колец, пластин и прочей фигни. На самом деле, нормально отношусь, но только в рамках очень узких показаний — ведь, если в гранулы биоматериала мы можем просто добавить аутокостную стружку и перемешать, то в готовый ксенокостный или синтетический блок аутокостную стружку не введешь — таким образом, мы получаем ограничение по толщине и возможностям пластики больших по размеру и сложных по форме костных дефектов. А то, что можно делать с этими самыми блоками и кольцами — гораздо проще (и дешевле) решается использованием гранулированного ксенографта, ну или вообще без такового.
Понимаю, всё это, может быть, выглядит слегка запутанным, поэтому для того, чтобы всё это максимально упростить резюмирую:
выбор метода остеопластики зависит не столько от объема, сколько от формы дефекта, наличия у него костных стенок и биотипа принимающего ложа. Чем больше расстояние от периметра до геометрического центра графта, тем больше аутокостной стружки требуется ввести в графт для его успешной регенерации.
Нужно больше клеток!
Итак, с периметром всё, более-менее ясно, теперь нам нужно решить, как улучшить миграцию клеток и васкуляризацию графта. Для этого нужны клетки и взять, как ни странно, мы их можем только c принимающего ложа (тезис #2).
Напомню, что компактная пластинка костной ткани, особенно при биотипах D1 и D2, не почти не содержит способных к миграции остеобластов и, по сути, является препятствием для неё.
Зная это, для получения хорошего результата остеопластики, мы должны решить две задачи:
— увеличить площадь контакта графта с принимающим ложем
— повысить удельное содержание клеток в поверхности принимающего ложа.
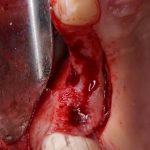
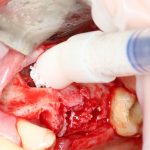
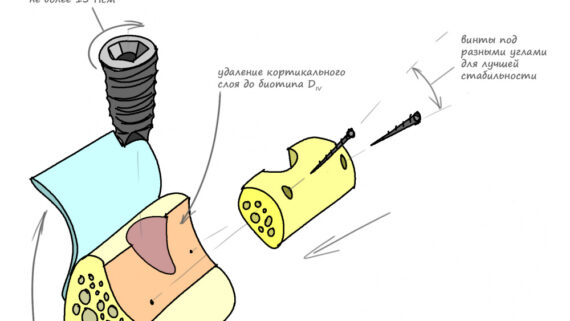
Сделать это не просто, а очень просто: мы просто обрабатываем принимающее ложе, снижая толщину компактной пластинки (вплоть до полного её удаления) и одновременно увеличивая площадь контакта с графтом:
Причём, целесообразно проводить такую манипуляцию даже в случаях, когда мы используем НКР-методы, а не только при аутотрансплантации блоков:
Обработка принимающего ложа или, если хотите, «декортикация» или «декомпактизация», преследует еще один важный момент. При разрущении кости, даже в очень небольших объемах, образуются факторы роста костной ткани, инициирующие остеогенез. А этого мы с вами, в общем-то, и добиваемся.
Теперь всё, что нам нужно — это создать некий пространственный каркас для клеток-мигрантов. А это, как раз делается с помощью графта, приём, совершенно любого.
Зачем нужны биоматериалы при остеопластике?
Глобально, все биоматериалы, использующиеся при остеопластических манипуляциях, можно разделить на две группы:
— барьерные мембраны, коллагеновые и не очень:

— графты (иначе говоря, спейсеры, остеокондукторы), т. н. «заменители костной ткани»:

Рассмотрим применение биоматериалов при остеопластике в контексте того, что мы теперь о ней знаем.
Пожалуй, стоит начать с того, что любую, практически любую операцию остеопластики можно провести без использования биоматериалов:
с закономерно хорошим результатом:
Однако, использование биоматериалов позволяет существенно упростить нашу работу, сделать её менее травматичной и более безопасной хотя бы потому, что отпадает необходимость в обширных вне- или внутриротовых донорских участках. С другой стороны, биоматериалы, в отличие от собственных тканей организма, не являются источниками регенерации, а служат лишь вспомогательным средством, они не улучшают, не ускоряют остеогенез, не улучшают качество костной ткани, а их применение — это дополнительные финансовые затраты. Вот почему относиться к ним нужно очень и очень осторожно, а применять лишь при необходимости.
Барьерные мембраны
Не акцентируя внимания на производителях и материалах, все существующие барьерные мембраны можно разделить на две большие группы: резорбируемые и не резорбируемые. В последнее время появились еще т. н. «полурезорбируемые» мембраны, т. е. с длинным сроком резорбции, но один фиг — они всё равно рано или поздно резорбируются так, что являются резорбируемыми.
Вопреки распространенному мнению, именно барьерные мембраны являются самым главным расходником при остеопластике. Потому, что используются не только при НКР:
но и, в некоторых случаях, при аутотрансплантации крупных костных фрагментов:
Чтобы понять, как работает барьерная мембрана, нужно вспомнить, что все ткани регенерируют с разной скоростью. В частности, миграция остеобластов, их дифференцировка, формирование костной мозоли, минерализация и окончательная перестройка кости происходит крайне медленно, в отличие от слизистой оболочки и других тканей (за исключением разве, что нервной). И, если мы хотим образования кости в обозначенном пространстве, нам необходимо чем-то отделить его от быстрорастущих мягких тканей. Причём, сделать это можно, буквально, всем, чем угодно: от специальной фольги до свободного соединительнотканного трасплантата. Правда, последним очень сложно работать.
Итак, первая функция барьерной мембраны — это изоляция:
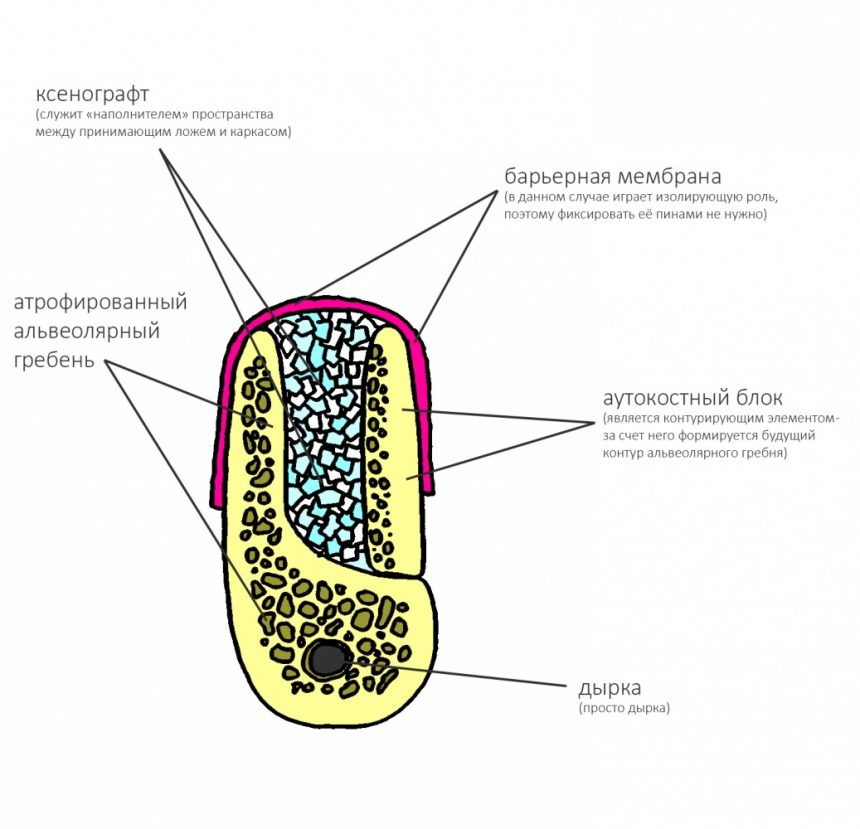
Это наглядно можно продемонстрировать на следующем примере.
Как видите, в данном случае с помощью блока всего лишь задан каркас, а между блоком и принимающим ложем, по сути,ничего нет:
Изоляция этой области с помощью барьерной мембраны:
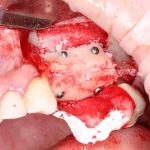
создает условия для миграции клеток, предотвращая прорастание мягких тканей между аутокостным блоком и принимающим ложем. И, как результат:
фактически, «из ничего» мы формируем достаточный объем костной ткани для установки имплантов.
Кроме того, современные барьерные мембраны обладают такой прочностью, что могут сами по себе играть роль каркаса:
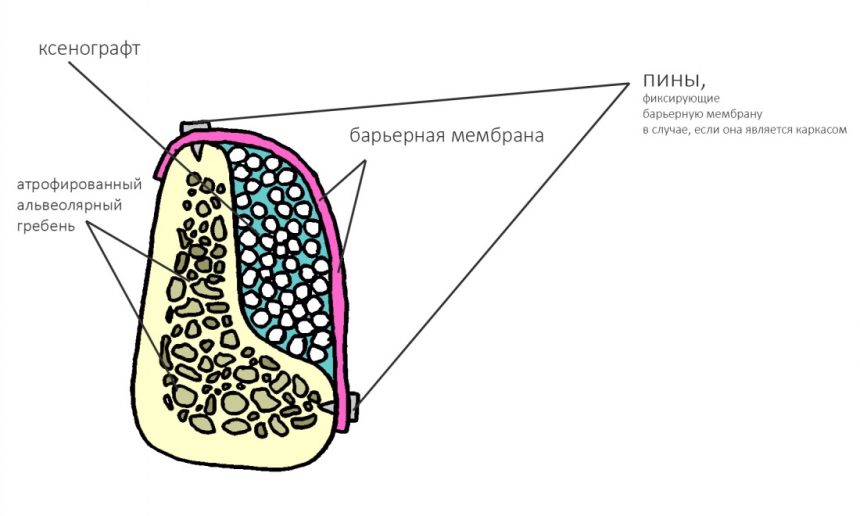
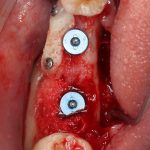
Это активно используется в различных методиках направленной костной регенерации:
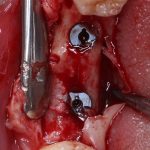
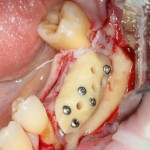
Однако, под действием развивающегося отека, под действием мышц или внешнего давления, барьерная мембрана может сместиться, а форма графта под ней — деформироваться. Поэтому, если барьерная мембрана является контурирующим элементом, её необходимо фиксировать пинами или винтами:
Это не всегда легко сделать, особенно с язычной или небной стороны, поэтому в последнее время мы вместо пинов используем швы. Сути дела это не меняет:
Итого, друзья, позвольте резюмировать:
Барьерная мембрана может играть две роли, изолирующую и контурирующую.
В случае, если контур будущего альвеолярного отростка задается какими-то другими элементами (блоком, пластиной, сеткой и т. д.), в фиксации большинства мембран нет необходимости
Если же барьерная мембрана сама по себе является каркасом (например, при НКР), то ее обязательно нужно фиксировать любым доступным способом.
Графты.
Ох, несмотря на то, что про использование графтов написано очень много (например, здесь, здесь и здесь), а в дискуссиях, какой же графт лучше, сломано немало копий и выколото немало глаз, я еще раз подниму эту тему.
Начну, пожалуй, с того, что принципиальной отличий в механизме действия различных графтов нет. Всё, начиная с ксенотрансплантатов и, заканчивая синтетикой, работает по одним и тем же принципам. В нашей клинике мы используем биоматериалы разных производителей, а их применение рассматривается, почти исключительно, с точки зрения удобства. Так, для лунок зубов, для аугментации при немедленной имплантации, мы используем Bio-Oss Collagen (Geistlich):
В то время, как для синуслифтинга можно использовать всё, что угодно:
На сегодняшний момент не существует графтов, улучшающих структуру костной ткани или её качество, стимулирующих остеогенез или ускоряющих регенерацию. Несмотря на то, что они могут существенно отличаться по своим физическим и биологическим свойствам, их назначение всегда одно:
заполнить и удержать объем, необходимый для регенерации костной ткани, создать, своего рода, матрицу, способную удержать в себе мигрирующие клетки.
И, учитывая то, что аутокостная стружка довольно быстро и сильно резорбируется (до 50-70% по данным некоторых авторов), медленно рассасывающийся ксенографт способен, хоть и не полностью, сохранить запланированную форму альвеолярного гребня.
Зная понятие периметра, мы с предсказуемо хорошим результатом можем регулировать слой графта в т. н. «пределах роста» костной ткани, т. е. расстояния, на которое способны двигаться клетки и расти сосуды.
В последнем предложении, по сути, раскрыт главный секрет применения графтов. Безусловно, эта тема еще требует специальных исследований и наблюдений, однако соблюдение этого простого правила (например, не больше 2-3 мм от периметра костного дефекта) позволит избежать многих проблем и осложнений в имплантологической практике.
Заключение
И, наконец, заканчивая эту нудную и непонятную статью, я хотел бы, уважаемые друзья, подвести некий общий, но не окончательный, итог.
Остеопластические операции — это нечто большее, чем просто насыпать-привинтить-прибить-закрыть-зашить. Как и вся имплантология, они основаны на свойстве организма к самовосстановлении и, по сути, проводя их, мы не делаем новую костную ткань — мы лишь пытаемся создать условия для её успешной регенерации. И для того, чтобы их создать, необходимо знать и, как минимум, представлять себе процессы, сопровождающие образование кости. Нужно знать, почему это происходит, за счет каких механизмов. Нужно уметь на эти механизмы влиять.
Впрочем, я периодически об этом на семинаре RegenerationDay, причем совершенно бесплатно. Так, что просто следите за расписанием и записывайтесь на ближайшее мероприятие.
Ну и, не переключайтесь далеко, подписывайтесь на блог и сайт — впереди еще много-много всего интересного. Например, «Рекомендации по установке имплантов» — четвертая часть статьи уже почти готова.
Спасибо, что дочитали до конца.
С уважением, Станислав Васильев.













Комментарии (1)